Гибридизация
Типы связей в молекулах органических веществ.
В органических соединениях углерод всегда четырехвалентен. В возбужденном состоянии в его атоме происходит разрыв пары $2s^3$-электронов и переход одного из них на р-орбиталь:
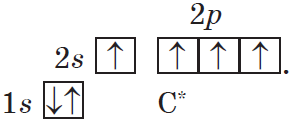
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
На основании приведенной электронной формулы валентного уровня атома углерода можно было бы ожидать, что на нем находится один $s$-электрон (сферическая симметричная орбиталь) и три $р$-электрона, имеющих взаимно перпендикулярные орбитали ($2р_х, 2р_у, 2p_z$-орбиталь). В действительности же все четыре валентных электрона атома углерода полностью эквивалентны и углы между их орбиталями равны $109°28'$. Кроме того, расчеты показывают, что каждая из четырех химических связей углерода в молекуле метана ($СН_4$) на $25%$ является $s-$ и на $75%$ — $p$-связью, т.е. происходит смешивание $s-$ и $р-$состояний электронов. Это явление называют гибридизацией, а смешанные орбитали — гибридными.
Атом углерода в $sp^3$-валентном состоянии имеет четыре орбитали, на каждой из которых находится по одному электрону. В соответствии с теорией ковалентной связи он имеет возможность образовывать четыре ковалентные связи с атомами любых одновалентных элементов ($СН_4, CHCl_3, CCl_4$) или с другими атомами углерода. Такие связи называются $σ$-связями. Если атом углерода имеет одну $С—С$ связь, то он называется первичным ($Н_3С—СН_3$), если две — вторичным ($Н_3С—СН_2—СН_3$), если три — третичным (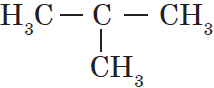 ), а если четыре — четвертичным (
), а если четыре — четвертичным (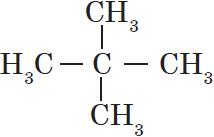 ).
).
Одной из характерных особенностей атомов углерода является их способность образовывать химические связи за счет обобщения только $р$-электронов. Такие связи называются $π$-связями. $π$-связи в молекулах органических соединений образуются только в присутствии $σ$-связей между атомами. Так, в молекуле этилена $Н_2С=СН_2$ атомы углерода связаны $σ-$ и одной $π$-связью, в молекуле ацетилена $НС=СН$ — одной $σ-$ и двумя $π$-связями. Химические связи, образовавшиеся с участием $π$-связей, называются кратными (в молекуле этилена — двойная, в молекуле ацетилена — тройная), а соединения с кратными связями — ненасыщенными.
Явление $sp^3$-, $sp^2$- и $sp$ - гибридизации атома углерода.
При образовании $π$-связей изменяется гибридное состояние атомных орбиталей атома углерода. Так как образование $π$-связей происходит за счет р-электронов, то в молекулах с двойной связью электроны будут иметь $sp^2$-гибридизацию (была $sp^3$, но один р-электрон отходит на $π$-орбиталь), а с тройной — $sp$-гибридизацию (два р-электрона отошли на $π$-орбиталь). Характер гибридизации изменяет направленность $σ$-связей. Если при $sp^3$-гибридизации они образовывают пространственно разветвленные структуры ($а$), то при $sp^2$-гибридизации все атомы лежат в одной плоскости и углы между $σ$-связями равны $120°$(б), а при $sp$-гибридизации молекула линейна (в):

При этом оси $π$-орбиталей перпендикулярны оси $σ$-связи.
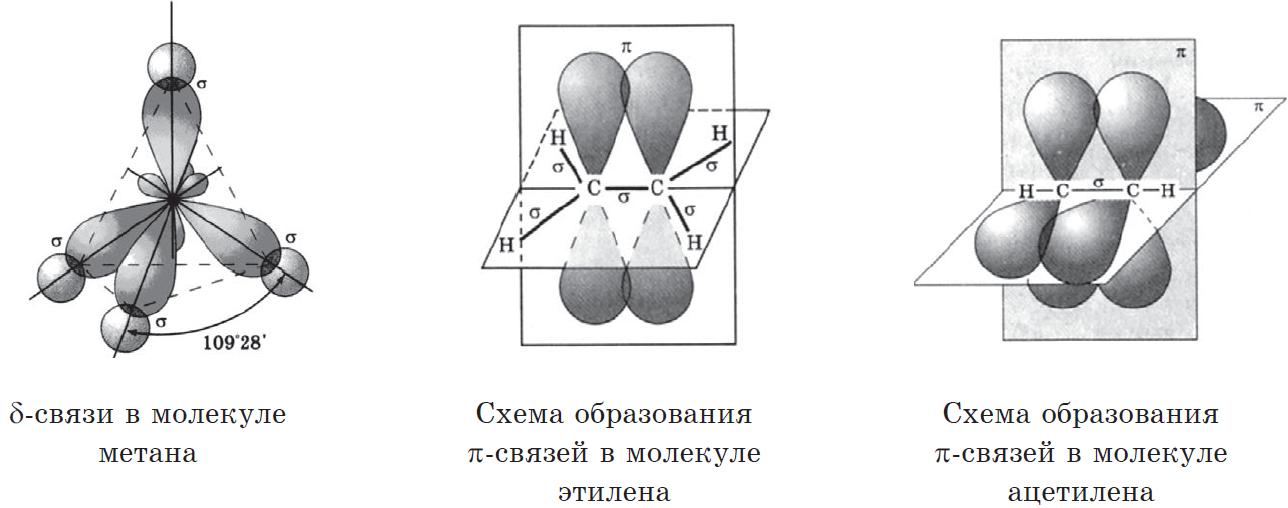
Как $σ$-, так и $π$-связи являются ковалентными, значит, должны характеризоваться длиной, энергией, пространственной направленностью и полярностью.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5'$ | $0.154$ | $369$ |
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
Радикал. Функциональная группа.
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (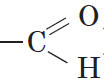 ), нитрогруппа (—$NO_2$) и т. д. являются функциональными группами спиртов, альдегидов и азотсодержащих соединений соответственно.
), нитрогруппа (—$NO_2$) и т. д. являются функциональными группами спиртов, альдегидов и азотсодержащих соединений соответственно.
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.





