Амины
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Соответственно, обычно выделяют три типа аминов:
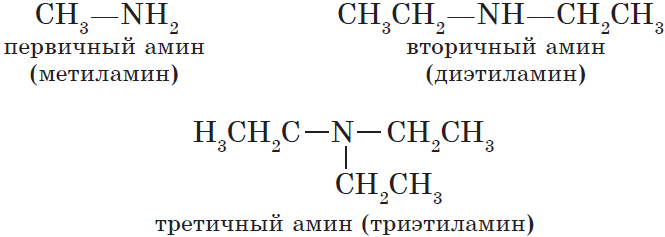
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную группу $NH^{2—}$, аминогруппу.
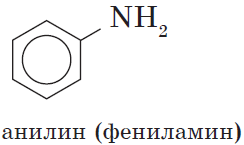
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония:
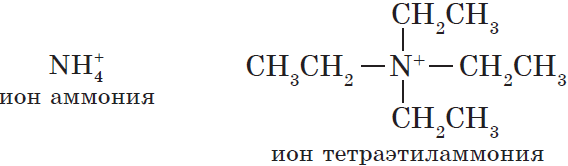
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура
Для аминов характерна структурная изомерия:
— изомерия углеродного скелета:
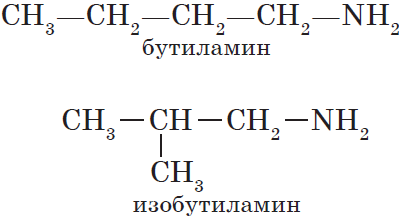
— изомерия положения функциональной группы:
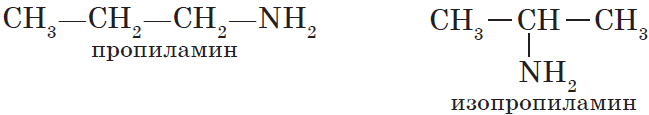
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
${CH_3-CH_2-CH_2-NH_2}↙{\text"первичный амин (пропиламин)"}$
${CH_3-CH_2-NH-CH_3}↙{\text"вторичный амин (метилэтиламин)"}$
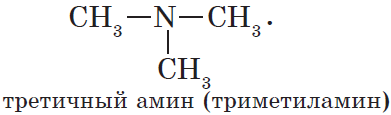
Как видно из приведенных примеров, для того, чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс -амин.
Физические и химические свойства аминов
Физические свойства.
Простейшие амины (метил амин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре $184°С$.
Химические свойства.
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т.е. выступать в роли основания:
$NH_3+H^{+}→{NH_4^{+}}↙{\text"ион аммония"}$
$CH_3CH_2—NH_2+H^{+}→CH_3—{CH_2—NH_3^{+}}↙{\text"ион этиламмония"}$
Известно, что реакция аммиака с водой приводит к образованию гидроксид-ионов:
$NH_3+H_2O⇄NH_3·H_2O⇄NH_4^{+}+OH^{-}$.
Раствор амина в воде имеет щелочную реакцию:
$CH_3CH_2-NH_2+H_2O⇄CH_3-CH_2-NH_3^{+}+OH^{-}$.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
$2NH_3+H_2SO_4→{(NH_4)_2SO_4}↙{\text"сульфат аммония"}$,
$CH_3—CH_2—NH_2+H_2SO_4→{(CH_3—CH_2—NH_3)_2SO_4}↙{\text"сульфат этиламмония"}$.
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
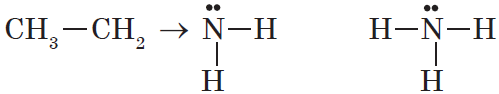
2. Амины горят на воздухе с образованием углекислого газа, воды и азота:
$4CH_3NH_2+9O_2→4CO_2↑+10H_2O+2N_2↑$





