Аминокислоты. Белки.
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу $—NH_2$ и карбоксильную группу $—СООН$, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
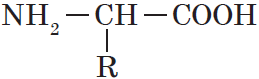
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа $—NH_2$ определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа $—СООН$ (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты:
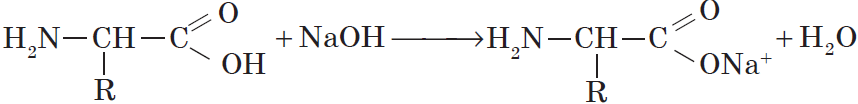
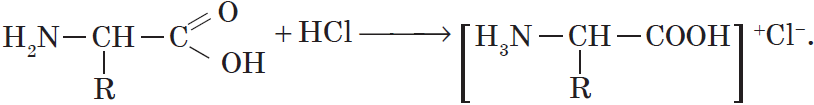
С сильными кислотами — как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
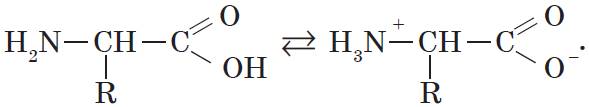
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше $200°С$. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала $R—$ они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около $150$) выделяют протеиногенные аминокислоты (около $20$), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т.к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки $—NH—CO—$, например:
${nNH_2—(CH_2)_5—COOH}↙{\text"аминокапроновая кислота"}→{(…—NH—(CH_2)_5—COO—…)_n}↙{\text"капрон"}+(n+1)H_2O$.
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Для получения синтетических волокон пригодны аминокислоты с расположением аминои карбоксильной групп на концах молекул.
Полиамиды $α$-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, пептиды, полипептиды. В таких соединениях группы $—NH—CO—$ называют пептидными.
Некоторые аминокислоты, входящие в состав белков.
| Название аминокислоты | Формула |
| Глицин (аминоуксусная) | $NH_2-CH_2-COOH$ |
| Аланин ($α$-аминопропионовая) | 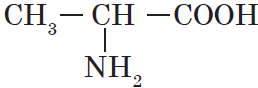 |
| Цистеин ($α$-амино-$β$меркаптопропионовая) | 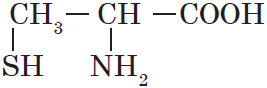 |
| Лизин ($α$, $ε$-диаминокапроновая) | 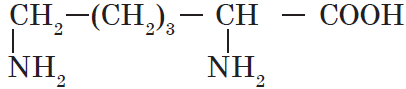 |
| Фенилаланин ($α$-амино-$β$фенилпропионовая) | 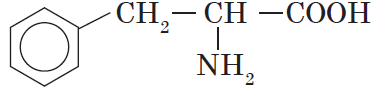 |
Белки
Белками, или белковыми веществами, называют высокомолекулярные (молекулярная масса варьируется от $5–10$ тыс. до $1$ млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (от греч. protos — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей, присущей ему, по следовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т.е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Строение белков
Все белки образованы двадцатью разными $α$-аминокислотами, общую формулу которых можно представить в виде
$R-CHNH_2-COOH$
где радикал R может иметь самое разнообразное строение.
Белки представляют собой полимерные цепи, состоящие из десятков тысяч, миллионов и более остатков $α$-аминокислот, связанных между собой пептидными связями. Последовательность аминокислотных остатков в молекуле белка называют его первичной структурой.
Для белковых тел характерны огромные молекулярные массы (до миллиарда) и почти макроразмеры молекул. Такая длинная молекула не может быть строго линейной, поэтому ее участки изгибаются и сворачиваются, что приводит к образованию водородных связей с участием атомов азота и кислорода. Образуется регулярная спиралевидная структура, которую называют вторичной структурой.
В белковой молекуле могут возникать ионные взаимодействия между карбоксильными и аминогруппами различных аминокислотных остатков и образование дисульфидных мостиков. Эти взаимодействия приводят к появлению третичной структуры.
Белки с $M_r > 50000$ состоят, как правило, из нескольких полипептидных цепей, каждая из которых уже имеет первичную, вторичную и третичную структуры. Говорят, что такие белки обладают четвертичной структурой.
Свойства белков
Белки — амфотерные электролиты. При определенном значении $рН$ среды (оно называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково.
Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения из растворов, например, в технологии получения белковых продуктов.
Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные ($—СО—NH—$, пептидная связь), аминные ($—NH_2$) и карбоксильные ($—СООН$) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению белков в осадок. При изменении $рН$ среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму.
Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет важную роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация белков. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т.е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость — газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества.
Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса: 1) гидролиз белков под действием ферментов; 2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров. Под влиянием протеаз-ферментов, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
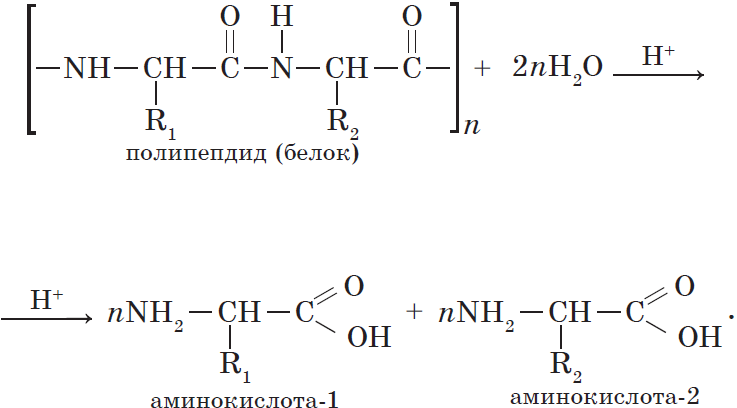
Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Цветные реакции. Используют следующие реакции:
— ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
— биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами $Cu^{2+}$ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.





