Соли
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен - та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{\text"(реакция обмена)"}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{\text"(реакция обмена)"}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{\text"(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)"}$.
4. Соль + металл ${→}↙{\text"(реакция замещения)"}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{\text"тетрагидроксоалюминат натрия"}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{\text"соль аммония"}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{\text"соль амина"}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
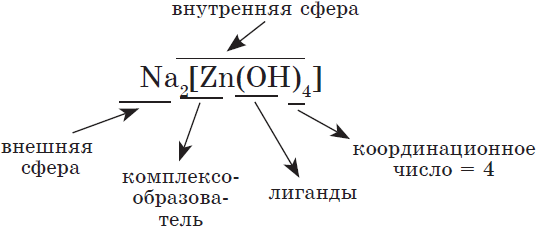
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.





