Окислительно-восстановительные реакции
Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от нее
Признаки окислительно-восстановительных реакций
Многообразие классификаций химических реакций по различным признакам (числу и характеру реагирующих и образовавшихся веществ, направлению, фазовому составу, тепловому эффекту, использованию катализатора) можно дополнить еще одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества.
Например, в реакции
${Ag}↖{+1}{N}↖{+5}{O_3}↖{-2}+{H}↖{+1}{Cl}↖{-1}={Ag}↖{+1}{Cl}↖{-1}+{H}↖{+1}{N}↖{+5}{O_3}↖{-2}$
степени окисления атомов химических элементов после реакции не изменились. А вот в реакции взаимодействия соляной кислоты с цинком
$2{H}↖{+1}{Cl}↖{-1}+{Zn}↖{0}={Zn}↖{+2}{Cl_2}↖{-1}+{H_2}↖{0}$
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород — с $+1$ на $0$, а цинк — с $0$ на $+2$. Следовательно, в этой реакции каждый атом водорода получил по одному электрону:
$2H^{+}+2e↖{-}→H_2^0,$
а каждый атом цинка отдал два электрона:
${Zn}↖{0}-2e↖{-}→Zn^{+2}.$
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Окислитель и восстановитель. Окисление и восстановление
Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами.
Степень окисления при этом понижается.
Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь:
${Cl^0+1ē}↙{\text"атом хлора"}→{Cl^{-1}}↙{\text"хлорид-ион"},$
${S^{0}+2ē}↙{\text"атом серы"}→{S^{-2}}↙{\text"хлорид-ион"}.$
Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:
${Cu^{+2}+2ē}↙{\text"ион меди(II)"}→{Cu^0}↙{\text"атом меди"},$
${Fe^{+3}+3ē}↙{\text"ион железа(III)"}→{Fe^{0}}↙{\text"атом железа"}.$
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается:
${Fe^{+3}+1ē}↙{\text"ион железа(III)"}→{Fe^{+2}}↙{\text"ион железа"},$
${Sn^{+4}+2ē}↙{\text"ион олова(IV)"}→{Sn^{+2}}↙{\text"ион олова(II)"}.$
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются:
${Na^{0}-1ē}↙{\text"атом натрия"}→{Na^{+1}}↙{\text"ион натрия"},$
${Al^{0}-3ē}↙{\text"атом алюминия"}→{Al^{+3}}↙{\text"ион алюминия"}.$
Отдавать свои электроны могут отрицательные ионы:
${Cl^{-1}-1ē}↙{\text"хлорид-ион"}→{Cl^{0}}↙{\text"атом хлора"},$
${S^{-2}-2ē}↙{\text"сульфид-ион"}→{S^{0}}↙{\text"атом серы"}.$
Терять электроны могут и некоторые положительные ионы с низшими степенями окисления:
${Cu^{+1}-1ē}↙{\text"ион меди(I)"}→{Cu^{+2}}↙{\text"ион меди(II)"},$
${Fe^{+2}-1ē}↙{\text"ион железа(II)"}→{Fe^{+3}}↙{\text"ион железа(III)"}.$
Можно отметить, что при этом степень окисления повышается.
Атомы, ионы или молекулы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
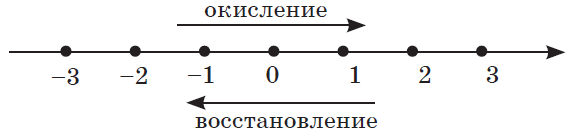
Зная формулу вещества и определив степени окисления атомов химических элементов в нем, нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом. Например, азот в азотной кислоте $H{N}↖{+5}O_3$ имеет максимальное значение степени окисления $+5$, т.е. он потерял все электроны, поэтому азот и азотная кислота будут проявлять только окислительные свойства.
Азот в аммиаке ${N}↖{-3}{H_3}↖{+1}$ имеет минимальное значение степени окисления $-3$, т.е. он не сможет принять больше ни одного электрона, и поэтому аммиак будет проявлять только восстановительные свойства.
Оксид азота (II) ${N}↖{+2}{O}↖{-2}$. Азот в этом соединении имеет промежуточное значение степени окисления и поэтому может проявлять как окислительные (например, $N^{+2}+2ē→N^0$ или $N^{+2}+5ē→N^{-3}$), так и восстановительные (например, $N^{+2}-2ē→N^{+4}$) свойства.
Метод электронного баланса
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Например, реакция взаимодействия алюминия с хлоридом меди (II) описывается схемой:
${Cu}↖{+2}{Cl_2}↖{-1}+{Al}↖{0}→{Al}↖{+3}{Cl_3}↖{-1}+{Cu}↖{0},$
а электронные уравнения будут иметь вид:
${Cu^{+2}+2ē→Cu^0}↙{\text"окислитель"}↖{\text"восстановитель"}|3,$
${Al^{0}-3ē→Al^{+3}}↙{\text"окислитель"}↖{\text"восстановитель"}|2.$
Молекулярное уравнение этой реакции:
$3CuCl_2+2Al=2AlCl_3+3Cu$.
Покажем, как с помощью метода электронного баланса можно расставить коэффициенты в уравнении сложной окислительно-восстановительной реакции. Известно, что первое правило ряда напряжений металлов о взаимодействии металлов с растворами кислот не распространяется на концентрированную серную кислоту и азотную кислоту любой концентрации.
В отличие от соляной кислоты, в которой окислителем атомов металла были катионы водорода, в серной и азотной кислотах окислителями являются атомы серы и азота из сульфат-ионов и нитрат- ионов. Поэтому $H_2SO_4$(конц.) и $HNO_3$(любой концентрации) взаимодействуют с металлами, стоящими в ряду напряжений как до водорода, так и после него, восстанавливаясь при этом до $SO_2$, $NO$ и т.д. Например, при взаимодействии разбавленной азотной кислоты с медью получаются нитрат меди (II), оксид азота (II) и вода. Запишем формулы исходных и конечных веществ с указанием степеней окисления:
${H}↖{+1}{N}↖{+5}{O_3}↖{-2}+{Cu}↖{0}→{Cu}↖{+2}({N}↖{+5}{O_3}↖{-2})_{2}+{N}↖{+2}{O}↖{-2}+{H_2}↖{+1}{O}↖{-2}.$
Подчеркнем знаки химических элементов, изменивших свои степени окисления:
$H{N}↙{-}↖{+5}O_{3}+{Cu}↙{=}↖{0}→{Cu}↙{=}↖{+2}(NO_3)_2+{N}↙{-}↖{+2}O+H_2O.$
Составим электронные уравнения, т.е. отразим процессы отдачи и присоединения электронов:
${N^{+5}+3ē→N^{+2}}↙{\text"окислитель"}↖{\text"восстановление"}|2,$
${Cu^{0}-2ē→Cu^{+2}}↙{\text"восстановитель"}↖{\text"окисление"}|3.$
Ставим коэффициент $3$ перед $Cu^0$ и перед формулой нитрата меди (II), в котором $Cu^{+2}$, так как с такими значениями степеней окисления медь встречается по одному разу. Коэффициент $2$ поставим только перед формулой вещества с $N^{+2}$, так как это значение степени окисления для азота в схеме реакции встречается только один раз, а вот перед $HNO_3$ коэффициент не запишем, ибо $N^{+5}$ встречается еще раз в формуле $Cu(NO_3)_2$. Наша запись имеет вид:
$HNO_3+3Cu→3Cu(NO_3)_2+2NO+H_2O.$
Теперь уравняем число атомов азота. После реакции оно равно $3·2=6$ из $Cu(NO_3)_2$ и еще два атома из $2NO$, всего $8$.
Поэтому перед $HNO_3$ запишем коэффициент $8$:
$8HNO_3+3Cu→3Cu(NO_3)_2+2NO+H_2O.$
и уравняем число атомов водорода:
$8HNO_3+3Cu→3Cu(NO_3)_2+2NO+4H_2O.$
Проверим правильность расстановки коэффициентов, подсчитав число атомов кислорода до и после реакции: до реакции — $24$ атома и после реакции — $24$ атома. Коэффициенты расставлены правильно, поэтому заменим в уравнении стрелку на знак равенства:
$8HNO_3+3Cu=3Cu(NO_3)_2+2NO+4H_2O.$
Коррозия металлов
При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто повторяем слова «ржавчина», «ржавление», видя коричнево-желтый налет на изделиях из железа и его сплавов. Ржавление — это частный случай коррозии.
Коррозия — это процесс самопроизвольного разрушения металлов под влиянием внешней среды.
Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т.д.
Коррозия металлов бывает сплошной и местной.
Первая не так опасна, как вторая, ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов — точечная. Она заключается в образовании сквозных поражений, т.е. точечных полостей — питтингов, при этом снижается прочность отдельных участков, уменьшается надежность конструкций, аппаратов, сооружений.
Коррозия металлов наносит большой экономический вред. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования.
Коррозия приводит к уменьшению надежности работы металлоконструкций. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий (например, деталей самолетов, лопастей турбин), а значит, увеличивать расход металла, что требует дополнительных экономических затрат.
Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции в результате разрушения газо-, нефте- и водопроводов. Нельзя не учитывать и ущерб природе, а значит, и здоровью человека, нанесенный в результате утечки нефтепродуктов и других химических веществ. Коррозия может приводить к загрязнению продукции, а следовательно, к снижению ее качества. Затраты на возмещение потерь, связанных с коррозией, колоссальны. Они составляют $30%$ годового производства металлов во всем мире.
Из всего сказанного следует, что очень важной проблемой является изыскание способов защиты металлов и сплавов от коррозии. Они весьма разнообразны. Но для их выбора необходимо знать и учитывать химическую сущность процессов коррозии.
По химической природе коррозия — это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии.
Виды коррозии
Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая.
I. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями-неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах.
Например:
$2{Fe}↖{0}+3{S}↖{+4}O_2+3{O_2}↖{0}→↖{t}{Fe_2}↖{+3}({S}↖{+6}{O_4}↖{-2})_3,$
$2{Fe}↖{0}+3{Cl_3}↖{0}→2{Fe}↖{+3}{Cl_3}↖{-1},$
$2{Zn}↖{0}+{O_2}↖{0}→2{Zn}↖{+2}{O}↖{-2}.$
Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные пленки. Если эта пленка прочная, плотная, хорошо связана с металлом, то она защищает металл от разрушения. Такие защитные пленки появляются у $Zn, Al, Cr, Ni, Pb, Sn, Nb, Ta$ и др. У железа она рыхлая, пористая, легко отделяется от поверхности и поэтому не способна защитить металл от дальнейшего разрушения.
II. Электрохимическая коррозия происходит в токопроводящей среде (в электролите с возникновением внутри системы электрического тока). Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Рассмотрим разрушение железного образца в присутствии примеси олова.
На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
${Fe}↖{0}-2e=Fe^{2+}$ (анод).
Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к олову — металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Таким образом, участки олова могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь олова выполняет роль катода.
В зависимости от среды электролита на катоде могут идти различные процессы. В одном случае будет наблюдаться выделение газа ($Н_2$). В другом — образование ржавчины, состоящей в основном из $Fe_2O_3·nH_2O$.
Итак, электрохимическая коррозия — окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения, которые являются менее активными проводниками (это может быть и неметалл).
На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение).
На катоде (менее активном проводнике) идет восстановление ионов водорода или молекул кислорода с образованием соответственно $Н_2↑$ или гидроксид-ионов $ОН^-$.
Катионы водорода и растворенный кислород — важнейшие окислители, вызывающие электрохимическую коррозию.
Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов — чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры.
Электролитом может служить морская вода, речная вода, конденсированная влага и, конечно же, хорошо известные вам электролиты — растворы солей, щелочей, кислот.
Вы, очевидно, помните, что зимой для удаления снега и льда с тротуаров используют техническую соль (хлорид натрия, иногда хлорид кальция). Образующиеся растворы стекают в канализационные трубопроводы, создавая тем самым благоприятную среду для электрохимической коррозии подземных коммуникаций.
Способы защиты от коррозии
Уже при проектировании металлических конструкций и их изготовлении предусматривают меры защиты от коррозии:
1. Шлифование поверхности изделий, чтобы на них не задерживалась влага.
2. Применение легированных сплавов, содержащих специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой (например, $Cr_2O_3$). Общеизвестны легированные стали — нержавейки, из которых изготавливают предметы домашнего обихода (ножи, вилки, ложки), детали машин, инструменты.
3. Нанесение защитных покрытий. Рассмотрим их виды.
А. Неметаллические — неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы.
Б. Химические — искусственно создаваемые поверхностные пленки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению — это процесс получения тончайшей пленки оксидов железа на поверхности стального изделия. Получаемая искусственная оксидная пленка очень прочная (в основном состава ${Fe}↖{+2}{Fe_2}↖{+3}O_4$ и придает изделию красивый черный цвет и синий отлив. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии.
В. Металлические — это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность — хромирование, никеля — никелирование, цинка — цинкование, олова — лужение и т.д. Покрытием может служить и пассивный в химическом отношении металл — золото, серебро, медь.
4. Электрохимические методы защиты.
А. Протекторная (анодная) — к защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других стальных изделий используют магний, алюминий, цинк.
Б. Катодная — металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность ее анодного разрушения.
5. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая конструкция.
А. Введение веществ-ингибиторов, замедляющих коррозию.
Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавлением пивных дрожжей, муки, крахмала. Эти примеси и были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате растворялись только окалина и ржавчина. Уральские оружейники применяли для этих целей «травильные супы» — растворы серной кислоты с добавкой мучных отрубей.
Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота — азотной кислотой, летучий диэтиламин впрыскивают в различные емкости. Отметим, что ингибиторы действуют только на металл, делая его пассивным по отношению к среде, например, к раствору кислоты. Науке известно более $5$ тыс. ингибиторов коррозии.
Б. Удаление растворенного в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.





