Электролиз
Теория к заданию 20 из ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
$NaCl→Na^{+}+Cl^{-}.$
Под действием электрического тока катионы $Na^{+}$ движутся к катоду и принимают от него электроны:
$Na^{+}+ē→{Na}↖{0}$ (восстановление).
Анионы $Cl^{-}$ движутся к аноду и отдают электроны:
$2Cl^{-}-2ē→{Cl_2}↖{0}↑$ (окисление).
Суммарное уравнение процессов:
$Na^{+}+ē→{Na}↖{0}|2$
$2Cl^{-}-2ē→{Cl_2}↖{0}↑|1$
$2Na^{+}+2Cl^{-}=2{Na}↖{0}+{Cl_2}↖{0}↑$
или
$2NaCl{→}↖{\text"электролиз"}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
Катодные процессы
| $Li K Ca Na Mg Al$ $Li^{+} K^{+} Ca^{2+} Na^{+} Mg^{2+} Al^{3+}$ |
$Mn Zn Fe Ni Sn Pb$ $Mn^{2+} Zn^{2+} Fe^{2+} Ni^{2+} Sn^{2+} Pb^{2+}$ |
$H_2$ $2H^{+}$ |
$Cu Hg Ag Pt Au$ $Cu^{2+} Hg_2^{2+} Ag^{+} Pt^{2+} Au^{3+}$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^{−};$ $M^{n+}$ не восстанавливается |
Восстанавливаются катионы металла и вода: $M^{n+}+nē=M^0$ $2H_2O+2ē=H_2↑+2OH^{−}$ | Восстанавливаются катионы металла: $M^{n+}+nē=M^0$ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) | |||
2. Процесс на аноде зависит от материала анода и от природы аниона.
Анодные процессы
| Кислотный остаток $Ас^{m–}$ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^{−}−nē=M^{n+}$ анод раствор | Окисление аниона (кроме $F^{–}$) $Ac^{m−}−mē=Ac^0$ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^{+}$ В щелочной среде: $4OH^{−}−4ē=O_2↑+4H^{+}$ |
|
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
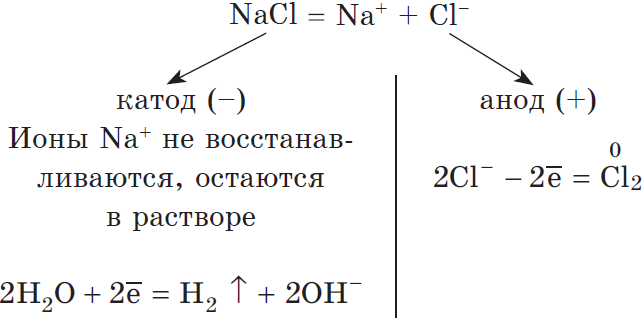
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$.
Учитывая присутствие ионов $Na^{+}$ в растворе, составляем молекулярное уравнение:
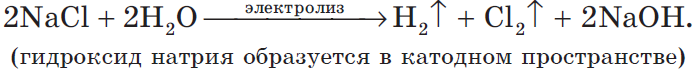
2) Анод растворимый (например, медный):
$NaCl=Na^{+}+Cl^{-}$.
Если анод растворимый, то металл анода будет окисляться:
$Cu^{0}-2ē=Cu^{2+}$.
Катионы $Cu^{2+}$ в ряду напряжений стоят после ($Н^{+}$), по этому они и будут восстанавливаться на катоде.
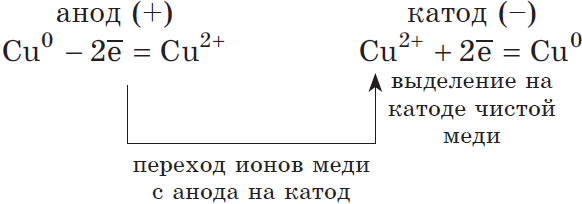
Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
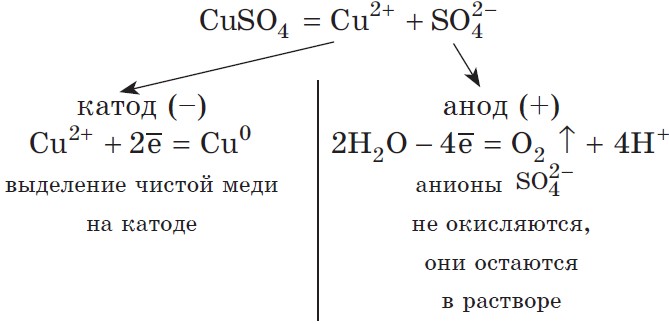
$Cu^{2+}+2ē=Cu^{0}|2$
$2H_2O-4ē=O_2↑+4H^{+}|1$
Суммарное ионное уравнение:
$2Cu^{2+}+2H_2O=2Cu^{0}+O_2↑+4H^{+}$
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^{2-}$ в растворе:
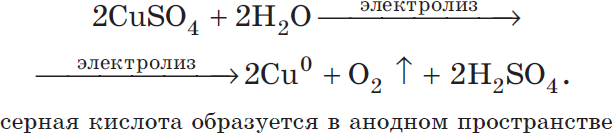
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
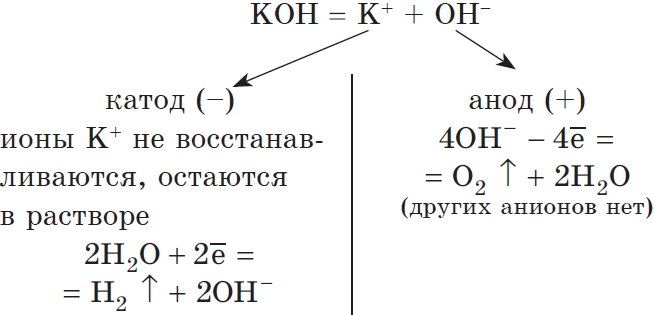
$2H_2O+2ē=H_2↑+2OH^{-}|2$
$4OH^{-}-4ē=O_2↑+2H_2O|1$
Суммарное ионное уравнение:
$4H_2O+4OH^{-}=2H_2↑+4OH^{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{\text"электролиз"}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.





