Классификация химических реакций в неорганической и органической химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
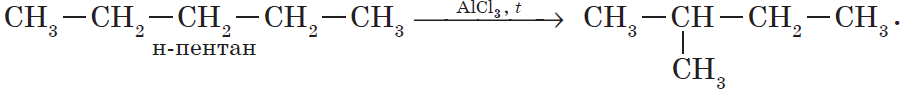
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
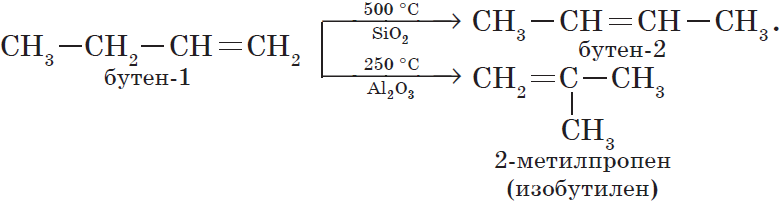
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
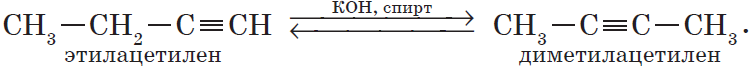
4. Изомеризация галогеналканов (А. Е. Фаворский).
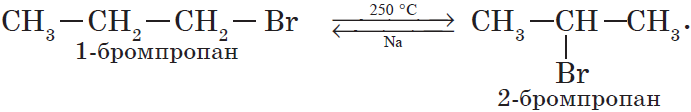
5. Изомеризация цианата аммония при нагревании.
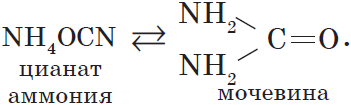
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ - из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{\text"уксусный альдегид"}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{\text"этиловый спирт"}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{\text"уксусный альдегид"}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{\text"этиловый спирт"}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
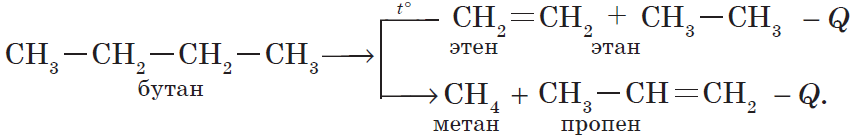
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
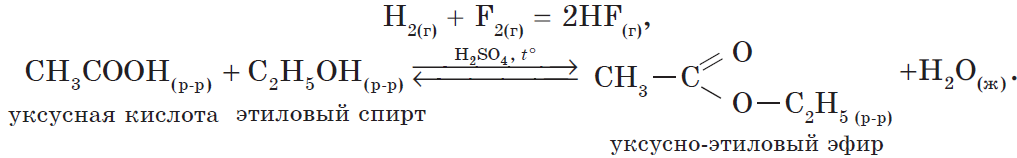
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование - дегидрирование;
- гидратация - дегидратация;
- полимеризация - деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.





