Электролитическая диссоциация. Реакции ионного обмена
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом $104.5°$, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
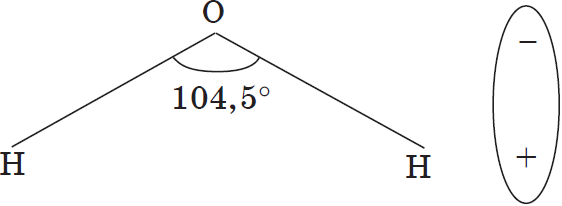
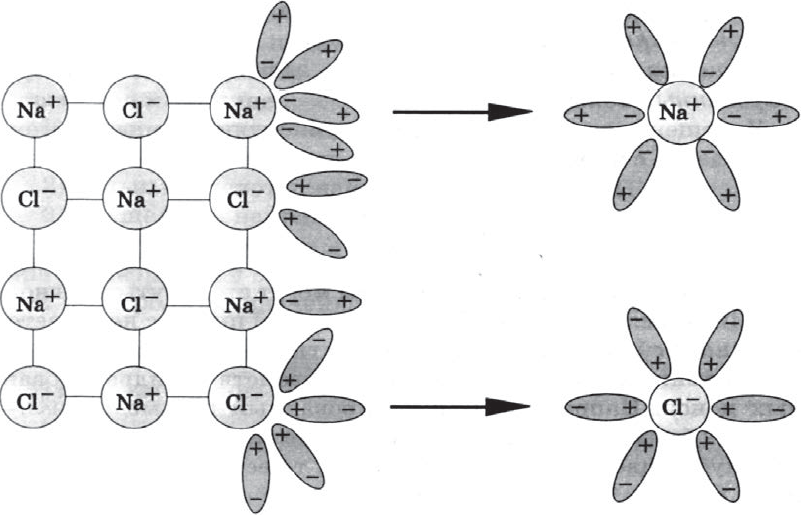
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
$NaCl=Na^{+}+Cl^{–}$.
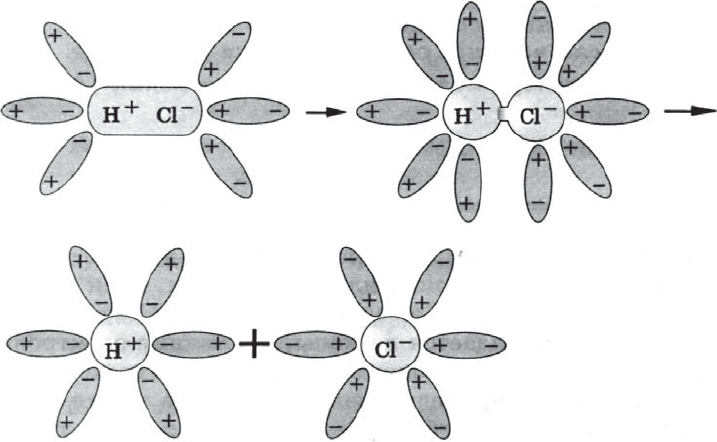
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная связь (например, молекулы хлороводорода $HCl$); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, такова:
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
$HCl=H^{+}+Cl^{–}$.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди $Cu^{2+}$ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т.е. связан с молекулами воды $Cu^{2+}·nH_2O$. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой $α$ (альфа).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
$α={N_g}/{N_p}$.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если $α=0$, то диссоциация отсутствует, а если $α=1$, или $100%$, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: $H_2SO_4, HCl, HNO_3$;
3) все щелочи, например: $NaOH, KOH$.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — $H_2S, H_2CO_3, HNO_2$;
2) водный раствор аммиака $NH_3·H_2O$;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
$CH_3COOH⇄H^{+}+CH_3COO^{–}$,
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
$K_{равн.}={[H^{+}]·[CH_3COO^{-}]}/{[CH_3COOH]}$
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия $Na0$ энергично взаимодействуют с водой, образуя при этом щелочь ($NaOH$) и водород $Н_2$, в то время как ионы натрия $Na^{+}$ таких продуктов не образуют. Хлор $Cl_2$ имеет желто-зеленый цвет и резкий запах, ядовит, а ионы хлора $Cl^{–}$ бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — $Cl^{–}, Na^{+}$ и сложные — $NH_4^{+}, SO_4^{2−}$.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^{+}, Na^{+}, NH_4^{+}, Cu^{2+}$) равна сумме зарядов анионов ($Cl^{–}, OH^{–}, SO_4^{2−}$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
$HNO_2⇄H^{+}+NO_2^{-}$
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул $CH_3COOH$, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов $H^{+}$.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
При растворении в воде кислоты диссоциируют с образованием катионов водорода $Н^{+}$ (точнее, ионов оксония $Н_3О^{–}$), которые определяют общие свойства кислот, такие как кислый вкус, изменение окраски индикатора и др., и отрицательно заряженных ионов, соответствующих кислотным остаткам. При ионной необратимой диссоциации, когда в растворе молекул нет, кислота называется сильной. При обратимой диссоциации, когда в растворе кислоты, наряду с соответствующими ионами, остаются и молекулы, кислота называется слабой. К сильным кислотам относятся азотная, серная, соляная и некоторые другие. Слабые кислоты — фтороводородная (плавиковая), угольная, сероводородная, фосфорная, органические кислоты и др.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
$Zn + 2H^{+} = Zn^{2+} + H_2↑;$
— с основными оксидами:
$CuO + 2H^{+} = Cu^{2+} + H_2O;$
— с щелочами:
$H^{+} + OH^{–} = H_2O;$
— с нерастворимыми основаниями:
$Fe(OH)_3 + 2H^{+} + 2H_2O$.
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Для серной кислоты $H_2SO_4$:
$Ba^{2+} + SO_4^{2–}={BaSO_4↓}↙{белый}$,
для угольной кислоты $H_2CO_3$:
$Ca+CO_3^{2-}={CaCO_3↓}↙{белый}$,
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
${3H_2SO_4}↙{сильная}+Ca_3(PO_4)_2={2H_3PO_4}↙{слабая}+3CaSO_4$
При растворении в воде основания образуют гидроксид-ионы ОН– и положительно заряженные ионы аммония $NH_4^{+}$). Растворимые в воде щелочи являются сильными электролитами, в их растворах молекул гидроксидов нет. Нерастворимые основания — слабые электролиты. Слабым электролитом является и гидроксид аммония $NH_4OH$, который представляет собой соединение молекулы аммиака с молекулой воды $NH_3·H_2O$. Специфические свойства оснований определяются свойствами иона металла.
Соли при растворении в воде диссоциируют с образованием положительно заряженных ионов металла (или аммония $NH_4^{+}$) и отрицательно заряженных кислотных остатков. Эти молекулы определяют поведение солей в растворах.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски инди





