Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
Химическое равновесие
Химические реакции, протекающие в одном направлении, называют необратимыми.
Большинство химических процессов являются обратимыми. Это значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах).
Например:
а) реакция
$CaCO_3{→}↖{t}CaO+CO_2↑$
в открытой системе необратима;
б) эта же реакция
$CaCO_3⇄CaO+CO_2$
в замкнутой системе обратима.
Рассмотрим более подробно процессы, протекающие при обратимых реакциях, например, для условной реакции:
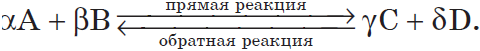
На основании закона действующих масс скорость прямой реакции
${υ}↖{→}=k_{1}·C_{A}^{α}·C_{B}^{β}$
Так как со временем концентрации веществ $А$ и $В$ уменьшаются, то и скорость прямой реакции тоже уменьшается.
Появление продуктов реакции означает возможность обратной реакции, причем со временем концентрации веществ $С$ и $D$ увеличиваются, а значит, увеличивается и скорость обратной реакции:
${υ}↖{→}=k_{2}·C_{C}^{γ}·C_{D}^{δ}$
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обратной реакций станут равными
${υ}↖{→}={υ}↖{←}$
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом деле и прямой, и обратный процессы продолжают идти, но с равной скоростью. Поэтому такое равновесие в системе называют подвижным и динамическим.
Константа равновесия
Обозначим равновесные концентрации веществ $[A], [B], [C], [D]$.
Тогда так как ${υ}↖{→}={υ}↖{←}, k_{1}·[A]^{α}·[B]^{β}=k_{2}·[C]^{γ}·[D]^{δ}$, откуда
${[C]^{γ}·[D]^{δ}}/{[A]^{α}·[B]^{β}}={k_1}/{k_2}=K_{равн.}$
где $γ, δ, α, β$ — показатели степеней, равные коэффициентам в обратимой реакции; $K_{равн.}$ — константа химического равновесия.
Полученное выражение количественно описывает состояние равновесия и представляет собой математическое выражение закона действующих масс для равновесных систем.
При неизменной температуре константа равновесия — величина постоянная для данной обратимой реакции. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Константы равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной темпера туре.
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания. Если получают $K_{равн.} >> 1$, это означает, что при равновесии $[C]^{γ}·[D]^{δ} >> [A]^{α}·[B]^{β}$, т. е. концентрации продуктов реакции преобладают над концентрациями исходных веществ, а выход продуктов реакции большой.
При $K_{равн.} << 1$ соответственно выход продуктов реакции мал. Например, для реакции гидролиза этилового эфира уксусной кислоты
$CH_3COOC_2H_5+H_2O⇄CH_3COOH+C_2H_5OH$
константа равновесия
$K_{равн.}={[CH_3COOH]·[C_2H_5OH]}/{[CH_3COOC_2H_5]·[H_2O]}$
при $20°С$ имеет значение $0.28$ (т.е. меньше $1$). Это означает, что значительная часть эфира не гидролизовалась.
В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
$CO_2+C⇄2CO$
константа равновесия выражается так:
$K_{равн.}={[CO]^2}/{[CO_2]}$
Значение константы равновесия зависит от природы реагирующих веществ и темпера туры.
От присутствия катализатора константа не зависит, по скольку он изменяет энергию активации и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, не влияя на значение константы равновесия.
Смещение равновесия под действием различных факторов
Состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях: температуре, концентрации исходных веществ, давлении (если в реакции участвуют или образуются газы).
Изменяя эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям. Такой переход называют смещением или сдвигом равновесия.
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
$N_2+3H_2⇄2HN_3+Q$
$K_{равн.}={[NH_3]^2}/{[N_2]·[H_2]^3}$
Влияние изменения концентрации веществ
При добавлении в реакционную смесь азота $N_2$ и водорода $Н_2$ увеличивается концентрация этих газов, а значит, увеличивается скорость прямой реакции. Равновесие смещается вправо, в сторону продукта реакции, т.е. в сторону аммиака $NH_3$.
Этот же вывод можно сделать, анализируя выражение для константы равновесия. При увеличении концентрации азота и водорода знаменатель увеличивается, а так как $K_{равн.}$ — величина постоянная, должен увеличиваться числитель. Таким образом, в реакционной смеси увеличится количество продукта реакции $NH_3$.
Увеличение же концентрации продукта реакции аммиака $NH_3$ приведет к смещению равновесия влево, в сторону образования исходных веществ. Этот вывод можно сделать на основании аналогичных рассуждений.
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газов, а значит, увеличивается их концентрация.
Предположим, что давление в замкнутой системе повысили, например, в $2$ раза. Это значит, что концентрации всех газообразных веществ ($N_2, H_2, NH_3$) в рассматриваемой нами реакции возрастут в $2$ раза. В этом случае числитель в выражении для $K_{равн.}$ увеличится в 4 раза, а знаменатель — в $16$ раз, т.е. равновесие нарушится. Для его восстановления должна увеличиться концентрация аммиака и должны уменьшиться концентрации азота и водорода. Равновесие сместится вправо. Изменение давления практически не сказывается на объеме жидких и твердых тел, т.е. не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Влияние изменения температуры
При повышении температуры, как вы знаете, скорости всех реакций (экзо- и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (в нашем примере эндотермической) увеличивается сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье (1884 г.):
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Сделаем выводы:
- при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
- при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
- при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
- при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
- при понижении температуры - в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.





