Химические свойства неметаллов
Простые вещества - неметаллы.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода $Н_2$, галогенов $F_2, Br_2, I_2$), двойные (например, в молекулах серы $S_2$), тройные (например, в молекулах азота $N_2$) ковалентные связи.
Как вам уже известно, простые вещества — неметаллы могут иметь:
- Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы ($H_2, N_2, O_2, F_2, Cl_2, O_3$) или твердые вещества ($I_2, P_4, S_8$), и лишь один-единственный бром ($Br_2$) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
- Атомное строение. Эти вещества образованы длинными цепями атомов ($Cn, Bn, Sin, Sen, Ten$). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул ($О_2, О_3$), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы-неметаллы, обладающие свойством аллотропии, обозначены в схеме звездочкой. Так что простых веществ — неметаллов гораздо больше, чем химических элементов — металлов. Вы знаете, что для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: $P, Se{аморф.}$ — желтые; $Bа{морф.}$ — коричневый; $О{2(ж)}$ — голубой; $Si, As{мет.}$ — серые; $Р_4$ — бледно-желтый; $I{1(г)}$ — фиолетово-черный с металлическим блеском; $Br{2(ж)}$ — бурая жидкость; $Cl{2(г)}$ — желто-зеленый; $F{2(г)}$ — бледно-зеленый; $S{8(т)}$ — желтая.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы — диэлектрики, т.к. все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Общие химические свойства неметаллов.
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
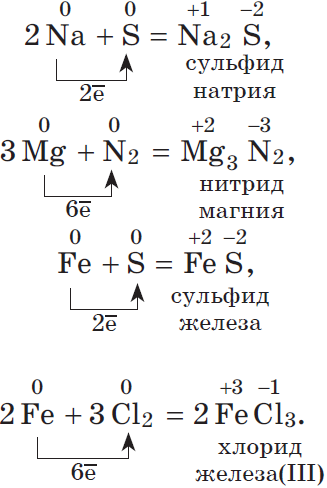
Окислительные свойства хлора $Cl_2$ выражены сильнее, чем у серы, поэтому и металл $Fe$, который имеет в соединениях устойчивые степени окисления $+2$ и $+3$, окисляется им до более высокой степени окисления.
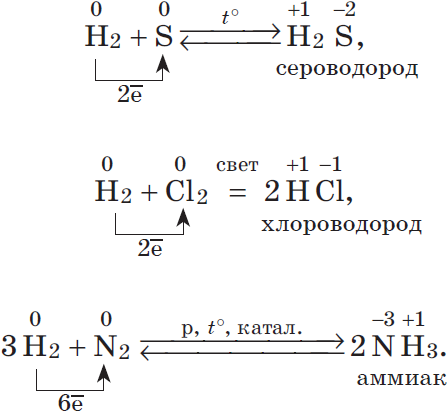
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
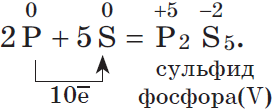
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
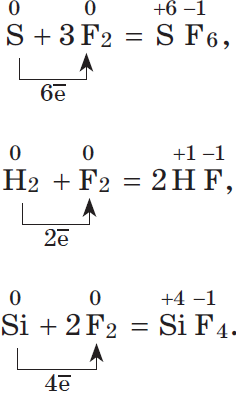
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор $F_2$ — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
а)${C}↖{-4}H_4+2{O_2}↖{0}→{C}↖{+4}{O_2}↖{-2}+2H_2{O}↖{-2}$
восстановитель ${C}↖{-4}-8{e}↖{-}→{C}↖{+4}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
б)$2{S}↖{+4}O_2+{O_2}↖{0}{→}↖{t°,кат.}2{S}↖{+6}{O_3}↖{-2}$
восстановитель ${S}↖{+4}-2{e}↖{-}→{S}↖{+6}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
а)$2{Fe}↖{+2}{Cl_2}↖{-1}+{Cl_2}↖{0}=2{Fe}↖{+3}{Cl_3}↖{-1}$
восстановитель ${Fe}↖{+2}-1{e}↖{-}→{Fe}↖{+3}|2$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-}|1$
Сильный окислитель хлор $Cl_2$ окисляет хлорид железа (II) в хлорид железа (III);
б)$2{K}↖{+1}{I}↖{-1}+{Cl_2}↖{0}={K}↖{+1}{Cl}↖{-1}+{I_2}↖{0}$
восстановитель $2{I}↖{-1}-2{e}↖{-}→{I_2}↖{0}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Хлор $Cl_2$ как более сильный окислитель вытесняет иод $I_2$ в свободном виде из раствора иодида калия;
в)${C}↖{-4}H_4+{Cl_2}↖{0}{→}↖{свет}{CH_3}↖{-2}{Cl}↖{-1}+H{Cl}↖{-1}$
восстановитель ${C}↖{-4}-2{e}↖{-}→{C}↖{-2}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Галогенирование метана — характерная реакция для алканов;
г)${C}↖{-2}H_2{=}↙{водный р-р}{C}↖{-2}H_2+{Br_2}↖{0}→{C}↖{-1}H_2{Br}↖{-1}-{C}↖{-1}H_2{Br}↖{-1}$
восстановитель ${C}↖{-2}-1{e}↖{-}→{C}↖{-1}|2$
окислитель ${Br_2}↖{0}+2{e}↖{-}→2{Br}↖{-1}|1$
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
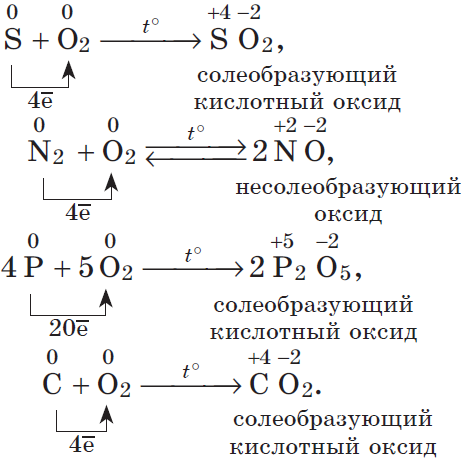
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: ${Cl_2}↖{+1}{O}↖{−2}, {Cl}↖{+4}{O_2}↖{-2}, {Cl_2}↖{+7}{O_7}↖{-2}, {Br_2}↖{+1}{O}↖{-2}, {Br}↖{+4}{O_2}↖{-2}, {I_2}↖{+5}{O_5}↖{-2}$ и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
а)${H_2}↖{0}+{{Cu}↖{+2}O}↙{оксид}{→}↖{t°}{Cu}↖{0}+{H_2}↖{+1}C$
восстановитель ${H_2}↖{0}-2{e}↖{-}→2{H}↖{+1}|1$
окислитель ${Cu}↖{+2}+2{e}↖{-}→{Cu}↖{0}|1$
б)$6{P}↖{0}+5{K{Cl}↖{+5}O_3}↙{соль}{→}↖{t}5K{Cl}↖{-1}+3{P_2}↖{+5}O_5$
восстановитель ${P}↖{0}-5{e}↖{-}→{P}↖{+5}|6$
окислитель ${Cl}↖{+5}+6{e}↖{-}→{Cl}↖{-1}|5$
в)${C}↖{0}+4{H{NO}↖{+5}O_3}↙{кислота}{→}↖{t°}{C}↖{+4}O_2↑+4{N}↖{+4}O_2↑+2H_2O$
восстановитель ${C}↖{0}-4{e}↖{-}→{C}↖{+4}|1$
окислитель ${N}↖{+5}+1{e}↖{-}→{N}↖{+4}|4$
г)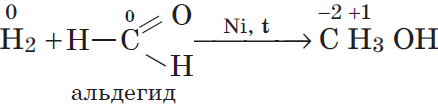
восстановитель ${H_2}↖{0}-2{e}↖{-}→{2H}↖{+}|1$
окислитель ${C}↖{0}+2{e}↖{-}→{C}↖{-2}|1$
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
а)${Cl_2}↖{0}+H_2O⇄H{Cl}↖{-1}+H{Cl}↖{+1}O$
восстановитель ${Cl}↖{0}-1{e}↖{-}→{Cl}↖{+1}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|1$
б)$3{Cl_2}↖{0}+6KOH=5K{Cl}↖{-1}+K{Cl}↖{+5}O_3+2H_2O$
восстановитель ${Cl}↖{0}-5{e}↖{-}→{Cl}↖{+5}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|5$
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору $F_2$).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период | Группа | ||||
| III | IV | V | VI | VII | |
| $2$ | ${B_2H_6}↙{диборан}$ | $ {CH_4}↙{метан}$ | $ {NH_3}↙{аммиак}$ | $ {H_2O}↙{вода}$ | $ {HF}↙{фтороводород}$ |
| $3$ | ${SiH_4}↙{силан}$ | $PH_3↙{фосфин}$ | ${H_2S}↙{сероводород}$ | ${HCl}↙{хлороводород}$ | |
| $4$ | ${AsH_3}↙{арсин}$ | ${H_2Se}↙{селеноводород}$ | ${HBr}↙{бромоводород}$ | ||
| $5$ | ${H_3Te}↙{теллуроводород}$ | ${HI}↙{йодоводород}$ | |||
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: $CH_4, NH_3, H_2O, H_2S, HCl$.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
$\table\ 1.H_2+Cl_2=2HCl; \ 2.N_2+3H_2⇄2NH_3;\}$ В промышленности так получают хлороводород и аммиак.
$\table\ 3.C+2H_2=CH_4; \ 4.2H_2+O_2=2H_2O; \ 5.H_2+S⇄H_2S;\}$ Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — $NH_3·H_2O$.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: $H_2S, H_2Se, H_2Te, HF, HCl, HBr, HI$.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго ($NH_3, H_2O, HF$) или третьего ($PH_3, H_2S, HCl$), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов $HF, HCl, HBr, HI$ прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах $HCl, HBr, HI$ диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от $HF$ к $HI$. При этом $HF$ относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей $…Н—F…H—F…$. Атомы водорода связаны с атомами фтора $F$ не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
* *Химические свойства водорода.
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
$H_2=2H – 432$ кДж$.
2. При обычных температурах водород вступает в реакцию с активными металлами:
$Ca+H_2=CaH_2$,
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
$F_2+H_2=2HF$.
3. При высоких температурах получают аммиак:
$N_2+3H_2=2NH_3$.
и гидрид титана (металл в порошке):
$Ti+H_2=TiH_2$.
4. При поджигании водород реагирует с кислородом:
$2H_2+O_2=2H_2O+484 кДж$.
5. Водород обладает восстановительной способностью:
$CuO+H_2=Cu+H_2O$.
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
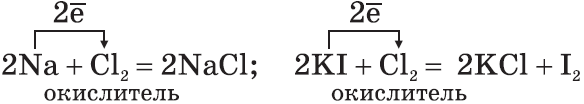
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
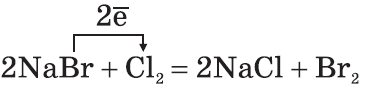
3. Галогены активно реагируют с неметаллами:
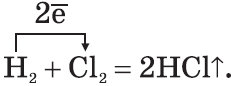 На свету взрывается.
На свету взрывается.
4. Галогены реагируют с водой, образуя атомарный кислород:
$H_2O+Cl_2=2HCl+O; O+O=O_2$.
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.
* *Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
- неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
- металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
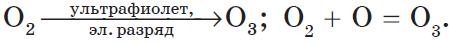
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{\text "(с кислородом серебро не реагирует)"\ }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°*{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: - с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ - со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ - с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: - горение серы $S+O_2=SO_2$ - обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична: 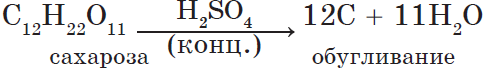 Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
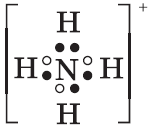
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония:
$NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)*3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO*{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя - с водой: $P_2O_5+3H_2O=2H_3PO_4$ - со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ - с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: - горения углерода в кислороде: $C+O_2=CO_2$ - окисления оксида углерода (II): $2CO+O_2=2CO_2$ - сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ - взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ - термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ - окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение - Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ - порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |