Водород, галогены
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
$H_2=2H – 432$ кДж$.
2. При обычных температурах водород вступает в реакцию с активными металлами:
$Ca+H_2=CaH_2$,
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
$F_2+H_2=2HF$.
3. При высоких температурах получают аммиак:
$N_2+3H_2=2NH_3$.
и гидрид титана (металл в порошке):
$Ti+H_2=TiH_2$.
4. При поджигании водород реагирует с кислородом:
$2H_2+O_2=2H_2O+484 кДж$.
5. Водород обладает восстановительной способностью:
$CuO+H_2=Cu+H_2O$.
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
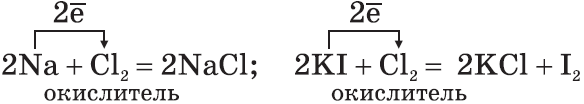
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
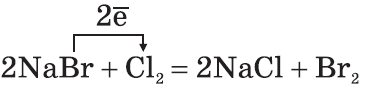
3. Галогены активно реагируют с неметаллами:
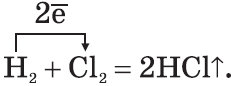 На свету взрывается.
На свету взрывается.
4. Галогены реагируют с водой, образуя атомарный кислород:
$H_2O+Cl_2=2HCl+O; O+O=O_2$.
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.





