Степень окисления и валентность
Электроотрицательность, степень окисления и валентность химических элементов
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО).
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью.
Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Существует шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
$F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs$. Наибольшее значение ЭО имеет фтор.
Сопоставляя значения ЭО элементов от франция $(0,86)$ до фтора $(4,1)$, легко заметить, что ЭО подчиняется Периодическому закону.
В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз).
В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными.
Вспомним типичные бинарные соединения, которые приводились в качестве примера для рассмотрения механизмов образования ионной и ковалентной полярной связи: $NaCl$ — хлорид натрия и $HCl$ — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом $+1$, а атом хлора принял электрон и превратился в ион с зарядом $–1$. Схематически процесс превращения атомов в ионы можно изобразить так:
${Na}↖{0}+{Cl}↖{0}→{Na}↖{+1}{Cl}↖{-1}$.
В молекуле же $HCl$ связь образуется за счет спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного $s$-облака атома водорода одноэлектронным $р$-облаком атома хлора:

При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора: ${H}↖{δ+}→{Cl}↖{δ−}$, т.е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов $δ$: $H^{+0,18}Cl^{–0,18}$. Если же представить, что и в молекуле $HCl$, как и в хлориде $NaCl$, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды $+1$ и $–1$: ${H}↖{+1}{Cl}↖{−1}. Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных атомов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
${Na_2}↖{+1}{S}↖{-2}, {Mg_3}↖{+2}{N_2}↖{-3}, {H_3}↖{-1}{N}↖{-3}, {Cl_2}↖{0}$.
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т.е. атомы более электроотрицательных элементов.
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т.е. атомы менее электроотрицательных элементов.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора: $Cl_2O_7$. Обозначим степень окисления кислорода: ${Cl_2}{O_7}↖{-2}$. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд $(–2)·7=–14$. Тогда общий заряд двух атомов хлора равен $+14$, а одного атома хлора $(+14):2=+7$.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например, карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия и углерода рядом — $AlC$, причем сначала — знак алюминия, т.к. это металл. Определим по таблице элементов Менделеева число внешних электронов: у $Al$ — $3$ электрона, у $С$ — $4$. Атом алюминия отдаст свои три внеш них электрона углероду и получит при этом степень окисления $+3$, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» $4$ электрона и получит при этом степень окисления $–4$. Запишем эти значения в формулу $({Al}↖{+3}{C}↖{-4})$ и найдем наименьшее общее кратное для них, оно равно $12$. Затем рассчитаем индексы:
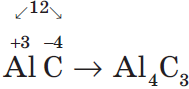
Валентность
Очень важное значение в описании химического строения органических соединений имеет понятие валентности.
Валентность характеризует способность атомов химических элементов к образованию химических связей; она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле.
Валентность атома химического элемента определяется, в первую очередь, числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
- числом неспаренных электронов (одноэлектронных орбиталей);
- наличием свободных орбиталей;
- наличием неподеленных пар электронов.
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.





