Щелочные и щелочноземельные металлы
Химические свойства щелочных металлов ($Na, K$)
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления $+1$. Все они типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:
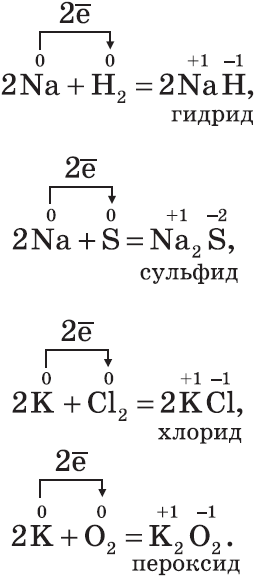
Все щелочные металлы при взаимодействии с кислородом (исключение — $Li$) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности.
Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:
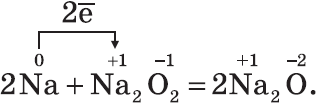
Гидроксиды $NaOH, KOH$ — твердые белые вещества, гигроскопичны, хорошо растворяются в воде с выделением теплоты, их относят к щелочам:
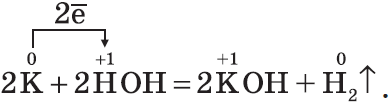
Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: $Na_2CO_3$ — карбонат натрия; $Na_2CO_3·10H_2O$ — кристаллическая сода; $NaHCO_3$ — гидрокарбонат натрия, пищевая сода; $K_2CO_3$ — карбонат калия, поташ; $Na_2SO_4·10H_2O$ — глауберова соль; $NaCl$ — хлорид натрия, пищевая соль.
Химические свойства щелочноземельных металлов ($Ca, Mg$)
Кальций ($Ca$) является представителем щелочноземельных металлов, как называют элементы главной подгруппы II группы, но не все, а только начиная с кальция и вниз по группе. Это те химические элементы, которые, взаимодействуя с водой, образуют щелочи. Кальций на внеш нем энергетическом уровне содержит два электрона, степень окисления $+2$.
Физические и химические свойства кальция и его соединений представлены в таблице.
Магний ($Mg$) имеет такое же строение атома, как и кальций, степень его окисления также $+2$. Мягкий металл, но его поверхность на воздухе покрывается защитной пленкой, что немного снижает его химическую активность. Его горение сопровождается ослепительной вспышкой. $MgO$ и $Mg(OH)_2$ проявляют основные свойства. Хотя $Mg(OH)_2$ и малорастворим, но окрашивает раствор фенолфталеина в малиновый цвет.
Оксиды $MgO$ — твердые белые тугоплавкие вещества. В технике $CaO$ называют негашеной известью, а $MgO$ — жженой магнезией, их используют в производстве строительных материалов.
Реакция оксида кальция с водой сопровождается выделением теплоты и называется гашением извести, а образующийся $Ca(OH)_2$ — гашеной известью. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь $Ca(OH)_2$ в воде — известковым молоком.
Соли магния и кальция получают взаимодействием их с кислотами.
$CaCO_3$ — карбонат кальция, мел, мрамор, известняк. Применяется в строительстве. $MgCO_3$ — карбонат магния — применяется в металлургии для освобождения от шлаков. $CaSO_4·2H_2O$ — гипс. $MgSO_4$ — сульфат магния — называют горькой, или английской, солью, содержится в морской воде. $BaSO_4$ — сульфат бария — благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в диагностике («баритовая каша») желудочно-кишечного тракта.
На долю кальция приходится $1,5%$ массы тела человека, $98%$ кальция содержится в костях.
Кальций и его соединения.
| Кальций | Оксид и гидроксид кальция | Соли кальция |
| 1. Серебристо-белый металл. 2. Активный металл, окисляется простыми веществами — неметаллами: $2Ca+O_2=2CaO$ $Ca+Cl_2=CaCl_2$ $Ca+S=CaS$ $Ca+H_2=CaH_2$ 3. Вытесняет водород из воды: $Ca+2H_2O=Ca(OH)_2+H_2↑$ 4. Вытесняет металлы из их оксидов (кальциотермия): $2Ca+ThO_2=Th+2CaO$ Получение Разложение электрическим током расплава хлорида кальция: $CaCl_2=Ca+Cl_2↑$ |
1. Порошки белого цвета. 2. Оксид кальция (негашеная известь) проявляет свойства основного оксида: а) взаимодействует с водой с образованием основания: $CaO+H_2O=Ca(OH)_2$ б) взаимодействует с кислотными оксидами: $CaO+SiO_2=CaSiO_3$ 3. Гидроксид кальция проявляет свойства сильного основания: $Ca(OH)_2=Ca^{2+}+2OH^{–}$ $Ca(OH)_2+CO_2=CaCO_3↓+H_2O$; $Ca(OH)_2+Ca(HCO_3)_2=2CaCO_3↓+2H_2O$$ Получение 1. Оксида — обжиг известняка: $CaCO_3=CaO+CO_2↑$ 2. Гидроксида — гашение негашеной извести: $CaO+H_2O=Ca(OH)_2$ |
1. Образует нерастворимый карбонат: $Ca^{2+}+CO_3^{2−}=CaCO_3↓$ и растворимый гидрокарбонат: $CaCO_{3(кр)}+CO_2+H_2O=Ca(HCO_3)_{2(р-р)}$ 2. Образует нерастворимый фосфат: $3Сa_{2+}+2PO_4^{3−}=Ca_3(PO_4)_2↓$ и растворимый дигидрофосфат: $Ca_3(PO_4)_{2(кр)}+4H_3PO_4=3Ca(H_2PO_4)_{2(р-р)}$ 3. Гидрокарбонат разлагается при кипячении или испарении раствора: $Ca(HCO_3)_2=CaCO_3↓+CO_2↑+H_2O$ 4. Обожженный природный гипс: $CaSO_4·2H_2O=CaSO_4·0,5H_2O+1,5H_2O$ затвердевает при взаимодействии с водой, снова образуя кристаллогидрат: $CaSO_4·0,5H_2O+1,5H_2O=CaSO_4·2H_2O$ |





