Карбоновые кислоты
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 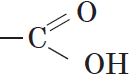 называется карбоксильной группой, или карбоксилом.
называется карбоксильной группой, или карбоксилом.
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
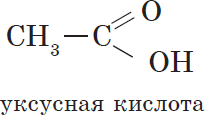
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
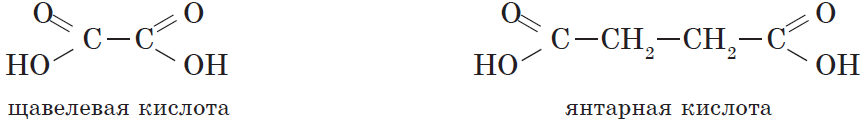
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
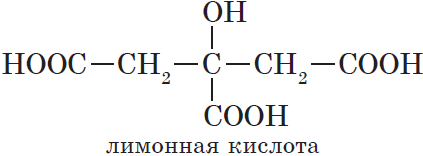
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
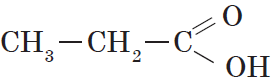
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)7—СН=СН—(СН_2)7—СООН$ и других кислот.
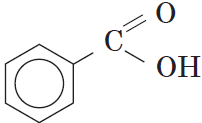
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
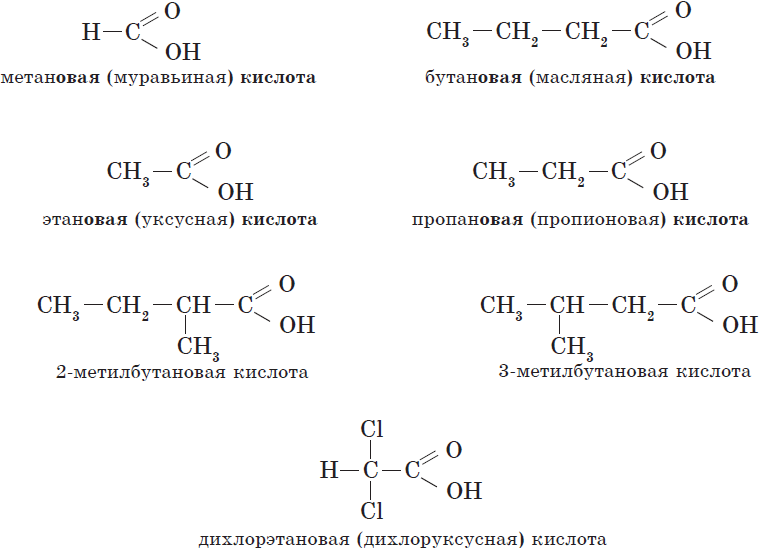
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
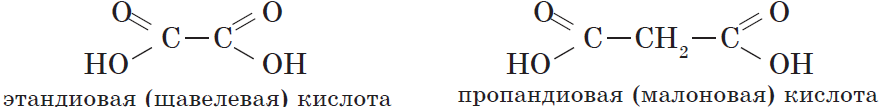
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН{2n}О_2$, или $С_nН{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
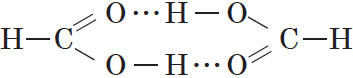
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 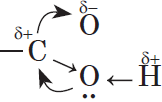 и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:
и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:
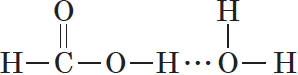
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO){n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO){2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO){2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)2→(R—COO){2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
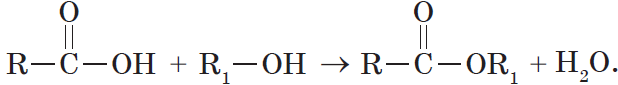
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
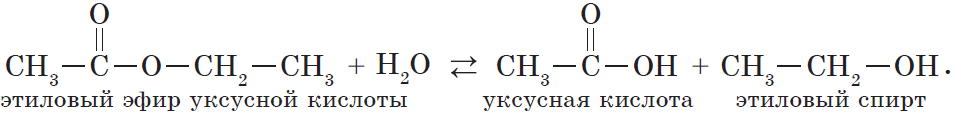
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
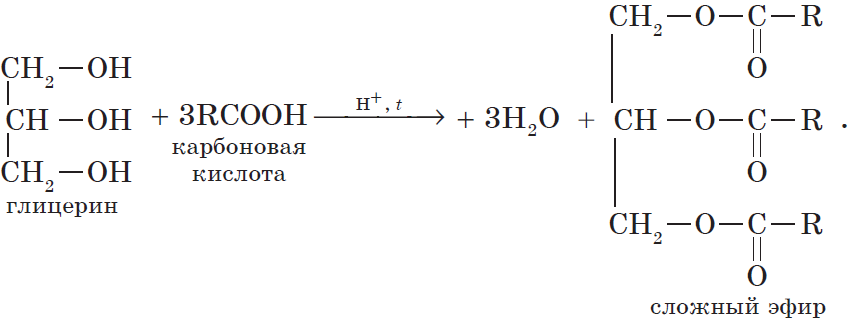
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{\text"олеиновая кислота"}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{\text"стеариновая кислота"}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{\text"акриловая(пропеновая)кислота"}→{CH_2Br—CHBr—COOH}↙{\text"2,3-дибромпропановая кислота"}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{\text"хлоруксусная кислота"}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{\text"дихлоруксусная кислота"}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{\text"трихлоруксусная кислота"}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.





