Азот, фосфор
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
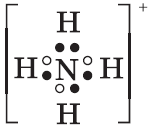
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония:
$NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя - с водой: $P_2O_5+3H_2O=2H_3PO_4$ - со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ - с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |